Агрегатні стани речовини
план
1. Введення
2.Агрегатное стан речовини
3.Агрегатное стан речовини - газ
4.Агрегатное стан речовини - рідина
5.Агрегатное стан речовини - тверде тіло
6.Четвертий стан речовини - плазма
7. Досвід: зміна агрегатного стану води
8.Заключеніе
Вступ
Як відомо, багато речовини в природі можуть перебувати в трьох станах: твердому, рідкому і газоподібному. А також деякі можуть перебувати ще й в четвертому - плазматичних стані Я вибрав цю тему тому що багато речовин використовуються в життя і в різних агрегатних станах. Метою даної роботи є - розглянути існуючі агрегатні стани речовини, виявити всі їхні переваги і недоліки.
Агрегатні стани речовини
Взаємне розташування, характер руху і взаємодії молекул одного і того ж речовини істотно залежать від зовнішніх умов (температура, тиск), характеризують його агрегатний стан. Розрізняють чотири агрегатних стани речовини: тверде, рідке, газоподібне, полум'яне. Фазовий перехід - перехід системи з одного агрегатного стану в інше. При фазовому переході стрибкоподібно змінюється якась фізична величина (наприклад, щільність, внутрішня енергія) або симетрія системи. Перехід речовини з твердого стану в рідке називається плавленням, а температуру, при якій це відбувається - температурою плавлення. Перехід речовини з рідкого стану в тверде називається кристалізацією, а температуру переходу - температурою кристалізації. Перехід речовини з рідкого стану в газоподібний називається паротворенням. Перехід речовини з газоподібного стану в рідке називається конденсацією. Реалізація того чи іншого агрегатного стану речовини залежить від співвідношення кінетичної і потенційної енергії молекул, що входять до його складу. Потенційна енергія молекули характеризує ступінь її зв'язку з іншими частинками. Між будь-якими двома молекулами речовини на відстані, більшій діаметру молекул, діють сили тяжіння електромагнітного походження. Ці сили прагнуть зв'язати молекули в єдине ціле. Кінетична енергія молекул перешкоджає цій тенденції зчеплення їх між собою.
газ


Газ (газоподібний стан) - одне з чотирьох агрегатних станів речовини, що характеризується дуже слабкими зв'язками між складовими його частками (молекулами, атомами або іонами), а також їх великою рухливістю. Частинки газу майже вільно і хаотично рухаються в проміжках між зіткненнями, під час яких відбувається різка зміна характеру їх руху. Так само термін «газ» можна визначити як речовину, температура якого дорівнює або перевищує критичну точку, при такій температурі стиснення газу не призводить до утворення рідини. В цьому і полягає відмінність газу від пара. При підвищенні тиску насичений пар частково перетворюється в рідину, газ немає. Речовина знаходиться в газоподібному стані, якщо середня кінетична енергія молекул перевищує їх середню потенційну енергію. Газоподібний стан речовини в умовах, коли можливе існування стійкої рідкої або твердої фази цієї ж речовини, зазвичай називається парою. Подібно рідин, гази мають плинністю і чинять опір деформації. На відміну від рідин, гази не мають фіксованого обсягу і не утворюють вільної поверхні, а прагнуть заповнити весь доступний обсяг (наприклад, судини). Гази можуть необмежено розширюватися в просторі, так як сили тяжіння між молекулами незначні. Велика стисливість газів порівняно зі сжимаемостью рідин і твердих тіл пояснюється наявністю більшого міжмолекулярної простору (рис.1).
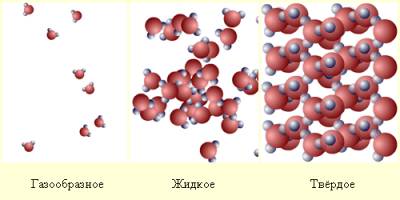
рис.1
При стисненні газу зменшується середня відстань між його молекулами. Однак сили взаємного відштовхування молекул на цій відстані невеликі і практично не перешкоджають стиску.
РІДИНА


Рідина - речовина, що знаходиться в рідкому агрегатному стані, що займає проміжне положення між твердим і газоподібним станами. Речовина знаходиться в рідкому агрегатному стані, якщо середня кінетична енергія молекул порівнянна із середньою потенційною енергією їх тяжіння. Основною властивістю рідини, що відрізняє її від речовин, що знаходяться в інших агрегатних станах, є здатність необмежено змінювати форму під дією дотичних механічних напружень, навіть як завгодно малих, практично зберігаючи при цьому обсяг. При нагріванні твердого тіла середня кінетична енергія молекул, хто вагається близько положень рівноваги, зростає. Зростання кінетичної енергії молекул призводить до збільшення амплітуди її коливань. Зменшення енергії зв'язку при нагріванні дозволяє молекулам перескакувати з одного положення рівноваги в інше. В результаті порушується правильне розташування частинок, характерне для кристалічної решітки твердого тіла. Відбувається фазовий перехід речовини з твердого стану в рідке. Молекули в рідині упаковані так само щільно, як і в твердому тілі, так як щільність рідини і твердого тіла приблизно однакова. При упаковці частинок в рідині, так само як і в твердих тілах, впорядковане розташування частинок спостерігається лише в межах двох-трьох шарів. Це означає, що при фазовому переході тверде тіло-рідина відбувається порушення симетрії системи. Відносні положення молекул в рідині не фіксовані. Під дією зовнішньої сили рідина тече, зберігаючи свій обсяг, і приймаючи форму судини. Плинність рідини пояснюється тим, що переходи молекул з одного положення рівноваги в інше відбуваються переважно в напрямку дії зовнішньої сили. Речовина в рідкому стані існує в певному інтервалі температур, нижче якого переходить в твердий стан (відбувається кристалізація або перетворення в твердотельное аморфний стан - скло), вище - в газоподібний (відбувається випаровування). Межі цього інтервалу залежать від тиску. Як правило, речовина в рідкому стані має тільки одну модифікацію. Всі рідини прийнято ділити на чисті рідини і суміші. Деякі суміші рідин мають велике значення для життя: кров, морська вода і ін. Рідини можуть виконувати функцію розчинників. Рідина надзвичайно важко стиснути механічно, оскільки, на відміну від газу, між молекулами дуже мало вільного простору. Тиск, вироблене на рідину, укладену в посудину, передається без зміни в кожну точку обсягу цієї рідини. Ця особливість, поряд з дуже малою сжимаемостью, використовується в гідравлічних машинах.
ТВЕРДІ ТІЛА


Тверде тіло - це одне з чотирьох агрегатних станів речовини, що відрізняється від інших агрегатних станів (рідини, газів, плазми) стабільністю форми і характеромтеплового руху атомів, що здійснюють малі коливання біля положень рівноваги. Речовина знаходиться в твердому стані, якщо середня потенційна енергія тяжіння молекул багато більше їх середньої кінетичної енергії. Розрізняють кристалічні і аморфні тверді тіла. Аморфні тіла - конденсовані речовини, атомна структура яких має ближній порядок, і не має далекого порядку, характерного для кристалічних структур. Кристалічні тіла - тверді тіла, в яких атоми розташовані закономірно, утворюють кристалічну решітку. Молекули в твердому тілі розташовуються впорядковано. Упаковка молекул в просторі аналогічна заповнення площини правильними багатокутниками. Частинки твердого тіла, утворюючи кристалічну решітку, коливаються близько деяких середніх положень рівноваги, званих вузлами кристалічної решітки. Коливання молекул можливі за різними напрямками і можуть мати різну амплітуду. Значна середня потенційна енергія взаємодії перешкоджає зміни середньої відстані між ними. Наслідками цього є збереження твердими тілами форми та об'єму. У минулому тверде тіло застосовувалося як конструкційний матеріал і в основі вживання лежали безпосередньо відчутні механічні властивості як твердість, маса, пластичність, пружність, крихкість. У сучасному світі застосування твердого тіла грунтується на фізичних властивостях, які найчастіше виявляються тільки при лабораторних дослідженнях.
ПЛАЗМА

Плазма частково або повністю іонізований газ, утворений з нейтральних атомів (або молекул) і заряджених частинок (іонів і електронів). Найважливішою особливістю плазми є те що не дивлячись на наявність вільних зарядів, сумарний електричний заряд плазми приблизно дорівнює нулю, це означає, що об'ємні щільності позитивних і негативних заряджених частинок, з яких вона утворена, виявляються майже однаковими. Плазма іноді називається четвертим (після твердого, рідкого і газоподібного) агрегатним станом речовини. Присутність вільних електричних зарядів робить плазму провідним середовищем, що обумовлює її помітно більше взаємодія з магнітним і електричним полями. Класифікація Плазма зазвичай поділяється на ідеальну і неідеальну, низькотемпературну і високотемпературну, рівноважну і нерівноважну, при цьому досить часто холодна плазма буває нерівноважної, а гаряча рівноважною. Плазму ділять на низькотемпературну (температура менше мільйона K) і високотемпературну (температура мільйон K і вище). Такий поділ обумовлено важливістю високотемпературної плазми в проблемі здійснення керованого термоядерного синтезу. Різні речовини переходять в стан плазми при різній температурі, що пояснюється будовою зовнішніх електронних оболонок атомів речовини: чим легше атом віддає електрон, тим нижче температура переходу в полум'яне стан. У нерівноважної плазмі електронна температура істотно перевищує температуру іонів. Це відбувається через відмінності в масах іона і електрона, яке ускладнює процес обміну енергією. Така ситуація зустрічається в газових розрядах, коли іони мають температуру близько сотень, а електрони близько десятків тисяч K. У рівноважної плазмі обидві температури рівні. Оскільки для здійснення процесу іонізації необхідні температури, які можна порівняти з потенціалом іонізації, рівноважна плазма зазвичай є гарячою (з температурою більше кількох тисяч K). Ступінь іонізації Для того, щоб газ перейшов в стан плазми, його необхідно іонізувати. Ступінь іонізації пропорційна числу атомів, які віддали або поглинули електрони, і найбільше залежить від температури. Навіть слабо іонізований газ, в якому менше 1% часток знаходяться в іонізованому стані, може проявляти деякі типові властивості плазми (взаємодія з зовнішнім електромагнітним полем і висока електропровідність). Іонізація- процес утворення іонів з атомів. Для низькотемпературної плазми характерна мала ступінь іонізації (до 1%). Так як такі плазми досить часто вживаються в технологічних процесах, їх іноді називають технологічними плазмами Гаряча плазма майже завжди повністю іонізована (ступінь іонізації ~ 100%). Зазвичай саме вона розуміється під «четвертим агрегатним станом речовини». Прикладом може служити Сонце. Крім температури, яка має фундаментальну важливість для самого існування плазми, другим найбільш важливою властивістю плазми є щільність. Словосполучення щільність плазми зазвичай позначає щільність електронів, тобто число вільних електронів в одиниці об'єму.
Форми плазми:
Штучно створена плазма - Плазмові ракетні двигуни, плазмові лампи, що світить сфера ядерного вибуху і ін.
Земна природна плазма - Блискавка, Північне сяйво і ін.
Космічна плазма - Сонце і інші зірки, космічний простір тощо.
Досвід: зміна агрегатного стану води
1.Берем лід (твердий стан води)
2.Нагреваем його до переходу в рідкий стан
3.Нагреваем до кипіння і переходу в газоподібний стан
висновок
Підіб'ємо підсумки виконаної роботи:
Газ - агрегатний стан речовини, в якому його частки не пов'язані або дуже слабо пов'язані силами взаємодії і рухаються вільно, заповнюючи весь наданий їм об'єм.
Рідина - агрегатний стан речовини, проміжне між твердим і газоподібним станами. Рідина, зберігаючи окремі риси як твердого тіла, так і газу, володіє, проте, поруч тільки їй властивих особливостей, з яких найбільш характерна - плинність. Подібно до твердого тіла, рідина зберігає свій обсяг, має вільну поверхню.
Тверде тіло - одне з чотирьох агрегатних станів речовини, що відрізняється від інших агрегатних станів стабільністю форми і характером теплового руху атомів, що здійснюють малі коливання біля положень рівноваги. Кристали характеризуються далеким порядком в розташуванні атомів. В аморфних тілах дальній порядок відсутній.
Плазма - частково або повністю іонізований газ, в якому густини позитивних і негативних зарядів практично однакові.
Виконав: Латишев Аркадій



